par J. M. DANZE
(Licencié ès Sciences Chimiques, Univ. Liège, ex assistant à l’Institut de Pharmacie, Consultant en biophysique).
Lorsque deux métaux différents sont simultanément plongés dans un électrolyte commun, il apparaît entre ces deux métaux une différence de potentiels électriques. Celle-ci peut se mesurer en Volts (V) ou en millivolts (mV).
Nous savons que la salive est un électrolyte de composition très complexe, voisine de celle de l’eau de mer , dont le pH varie entre 6,3 et 7,3 et dont la température oscille autour de 37 °C.
Lorsque, dans la cavité buccale, des alliages ou des amalgames de compositions différentes sont en présence, il apparaît parfois des différences de potentiels électriques entre deux pièces métalliques. Ces différences de potentiel (mesurées en valeurs relatives) peuvent atteindre jusqu’à 1500 mV et même davantage.
On attachait jadis peu d’importance à ce phénomène, sans doute parce qu’on ne concevait pas qu’il pu être à la base de processus iatrogènes, mais aujourd’hui, le développement des connaissances en physiologie et particulièrement en toxicologie des métaux a mis la question des métaux prothétiques à l’avant plan de l’actualité.
Le prof. R. Soremark du Karolinska Institut de Stockholm [1] a objectivé ces migrations ioniques qui avaient déjà fait l’objet de nombreuses publications en Allemagne bien avant la guerre [2]. Il suffit de 21 jours d’expérimentation pour montrer de façon indiscutable la corrosion d’amalgames, de crochets en chrome cobalt et l’augmentation de la concentration en Argent, Mercure dans l’émail et la dentine des dents obturées en amalgame.
Le même problème se pose en orthopédie et une nouvelle discipline en est issue; elle a pour objet la “biocompatibilité” des métaux. Les matériaux biocompatibles sont des matériaux que les cellules vivantes acceptent et intègrent dans la structure tissulaire (donc ne rejettent pas) [3]. Les essais de ces matériaux peuvent aisément se réaliser in vitro en les mettant par exemple en présence d’ostéoblastes (technique utilisée pour les implants) ou d’explants d’épithélium de gencive [4-5].
Les effets galvaniques dans la cavité buccale peuvent avoir deux types de conséquences nuisibles
1. la différence de potentiels peut par elle-même perturber le système neuro-végétatif du patient. N’oublions pas qu’actuellement, on admet que le potentiel de fonctionnement des membranes cellulaires (neurones) est d’environ 45 mV (Prix Nobel 1991, B. Sakmann et E. Neher). Or, durant le sommeil, le contact entre les mâchoires n’est pas fixe et la plupart des gens normaux accusent un très léger bruxisme, ce qui transforme alors le courant continu de base en impulsions lesquelles peuvent constituer des informations électriques perturbatrices.
On voit ainsi apparaître cette notion généralement assez mal comprise de “blocages” thérapeutiques possibles. L’individu se perturbe dans la sphère psycho-neuro-endocrinologique et peut devenir rebelle à toute thérapie.
Quand on observe la branche inférieure du nerf maxillaire et la distribution de ses dendrites à chaque racine dentaire, on peut comprendre qu’une névralgie du trijumeau puisse avoir son siège à la suite d’un effet galvanique (micro-décharges électriques) se propageant depuis l’obturation vers le nerf. La coagulation du ganglion de Gasser (pratiquée dans les cliniques de la douleur) est-elle la véritable solution ? Ne faudrait-il pas avant tout examiner les dents (potentiels électriques et dépassements de racines) ? En d’autres termes, faut-il détruire le signal d’alarme avant d’avoir découvert l’intrus ?
2. lorsque deux métaux différents constituent une pile (cfr. Pile de Daniell vue dans l’enseignement moyen), l’élément métallique le plus réactif (le plus électropositif) passe progressivement en solution sous la forme d’ions. La salive, avec sa composition particulière est un milieu idéal pour former cette pile entre les masses d’obturations ou de prothèses en présence dans la cavité buccale. Il s’agit là tout simplement d’un processus de corrosion électro-galvanique.
La corrosion électrique n’est pas un phénomène propre à la dentisterie; elle constitue une préoccupation majeure pour tous les électrochimistes et pour tous les ingénieurs métallurgistes [6]. Elle fait l’objet à elle seule d’une discipline relevant d’une spécialisation universitaire. Il est bien connu des plombiers, par exemple, que lorsque sur une conduite d’eau, on monte un raccord en laiton sur un tube en acier, l’acier va se corroder très rapidement.
En art dentaire, ce cas de figure dû à la présence d’un amalgame à côté ou sous une couronne en or peut induire une intoxication, une subintoxication ou une sensibilité allergique, suite à la libération d’argent, de mercure, de cuivre, d’étain.
Or, nous savons depuis quelques dizaines d’années que nos processus cellulaires sont régis par des enzymes spécifiques et les chercheurs ont pu recenser parmi ces enzymes plus de 600 métallo-enzymes nécessaires au métabolisme profond de nos cellules. Ces métallo-enzymes possédant dans leur structure un métal particulier (par exemple, la céruloplasmine , enzyme à base de cuivre permettant la fixation du fer) peuvent être sélectivement bloquées par un certain nombre de métaux dont l’encombrement atomique et la réactivité sont voisins de celui du métal spécifique à l’enzyme. En somme, ces métaux perturbateurs prennent la place du métal désigné sur la molécule, jouent en quelque sorte le rôle d’un leurre et la bloquent. Cet aspect de l’intoxication métallique est peu apparent au début de son processus et peut se traduire par une foule de symptômes disparates et non caractéristiques d’un syndrome particulier connu.
De plus, on sait également aujourd’hui que de faibles concentrations en nickel ou en cobalt ou en chrome empêchent la réparation des cordons d’ADN endommagés. Ceci peut dans certains cas induire un effet mutagène, voire carcinogène [11-12-13].
Ces motifs justifient amplement l’intérêt que tout thérapeute doit accorder aux phénomènes galvaniques dans la cavité buccale.
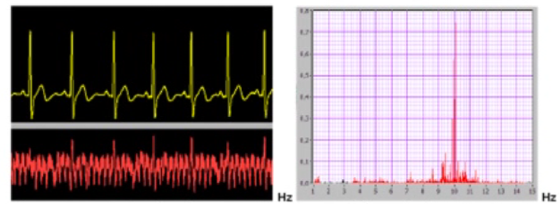
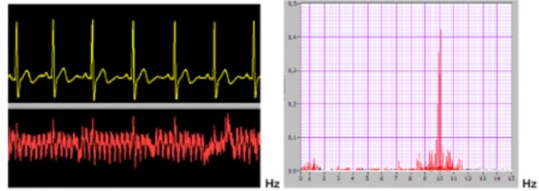
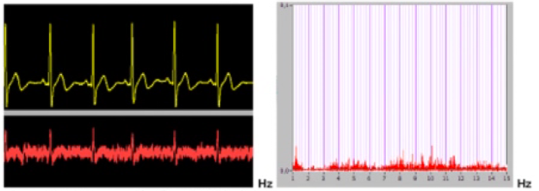
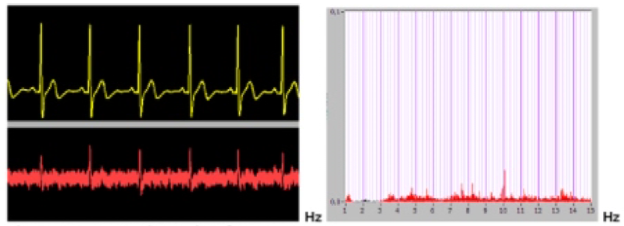
Le point 1 peut être facilement appréhendé et circonscrit grâce à la mesure des différences de potentiels, au moyen d’électrodes spéciales (autoclavables) adaptées à un simple millivoltmètre. On procède par mesures croisées. Le millivoltmètre indique la polarité de la pile buccale et le pôle le plus négatif sera constitué par l’alliage à éliminer. Il s’agira en général d’un alliage en métal vil ou d’un amalgame.
Plus la différence de potentiels d’électrodes entre les pièces métalliques en présence est élevée, plus les passages en solution sous forme d’ions seront facilités. La mesure de l’intensité de courant en µA fournit l’expression quantitative du phénomène, c’est à dire de la quantité de métal subissant la corrosion et se libérant sous forme d’ions. En somme la présence d’un courant mesurable en microampères confirme le fonctionnement réel et continu de la pile buccale.
Certains praticiens contestent cette méthode de mesure parce que ne faisant appel qu’à deux électrodes. En effet, nous pourrions mettre en œuvre une troisième électrode (dite de référence) afin d’obtenir des mesures en valeurs absolues. Ceci ne ferait que compliquer inutilement les choses, car ce que nous recherchons, c’est la différence de potentiels relative entre deux pièces métalliques afin de guider le praticien dans son travail d’élimination du ou des alliages (ou amalgames) responsables du phénomène.
Certains thérapeutes mesurent le courant galvanique entre la pièce prothétique et la muqueuse de la joue ou entre la pièce prothétique et la peau, ceci constitue une erreur, car la résistance interne de la pile ainsi mesurée est très élevée et ne reflète pas la réalité.
L’intérêt de la méthode réside précisément dans le fait de mesurer la différence de potentiels entre les deux points de contact d’une pile, comme nous le ferions pour évaluer une pile de torche électrique. Point n’est besoin d’avoir dépassé le niveau de l’enseignement secondaire pour le comprendre!
Il existe sur le marché allemand des appareils mesurant simultanément et enregistrant sur imprimante non seulement les différences de potentiels mais aussi le courant galvanique en micro-ampères (intensité du phénomène de corrosion indiquant la quantité d’ions libérés). (Un simple multimètre d’électricien muni d’électrodes adéquates peut permettre le même résultat mais requiert un certain tournemain !)
En ce qui concerne le point 2, voyons ce que nous dit l’électrochimie : il existe une échelle de potentiels d’oxydo-réduction des métaux (tableau 1)[7]. En somme, chaque métal entrant en réaction libère un ou plusieurs électrons et ce phénomène s’accompagne d’une différence de potentiels mesurable en millivolts (mV). La firme Sargent (Chicago) a édité en 1963 une échelle à curseurs intitulée “Sargent Chemical Predictor” permettant de prédire quels sont les métaux aptes à se déplacer mutuellement dans une réaction (analytique, par exemple) où ils seraient mis en présence.
Nous y trouvons par exemple :
Zn ?Zn2+ + 2e- (+ 763 mV par rapport à l’électrode normale d’hydrogène)
Si du zinc est mis en présence de cuivre dans une solution d’électrolyte, il va être mis en solution par le cuivre :
Cu ? Cu2+ + 2e- (- 337 mV / E.N.H.)
Car un métal ayant un potentiel de réaction négatif va déplacer un autre métal dont le potentiel est relativement plus positif.
Tableau des potentiels redox des métaux utilisés en dentisterie (le zéro est donné par l’électrode normale à hydrogène -E.N.H.)
La protection de pièces métalliques en acier (Fe) par galvanisation (Zn) est une application technologique de ce phénomène. Le zinc protège le fer en passant en solution.
Fe _ Fe2+ + 2e- (+ 440 mV / E.N.H.)
Zn _ Zn2+ + 2e- (+ 763 mV / E.N.H.)
?mV = 323 mV
Pendant la 2ème guerre mondiale, on laissait descendre le long de la coque des “Liberty Ships” attendant leur armement à quai, des cylindres de zinc reliés à la coque par des câbles soudés. Le zinc se corrodait en polarisant la coque et en laissant ainsi le fer intact, grâce à une différence de potentiels d’environ 323 mV (l’eau de mer servant d’électrolyte pour la pile ainsi formée).
Le phénomène est le même pour les pièces en alliages et les amalgames dans la bouche, mais là, c’est le passage en solution du métal le plus électropositif (le plus réactif) qui nous préoccupe. Le contact direct métal/métal entre les pièces buccales n’est pas nécessaire pour engendrer ce phénomène [2], la conductivité de la salive suffit.
Nous savons aujourd’hui que 28 métaux différents (et 2 non métaux) sont utilisés dans la réalisation des prothèses dentaires métalliques.
Les métaux principaux, quantitativement, sont le Béryllium (ou Glucinium), l’Aluminium, le Titane, le Tantale, le Manganèse, le Ruthénium, le Chrome, le Gallium, le Germanium, le Fer, le Cobalt, le Zinc, le Nickel, l’Indium, l’Etain, le Molybdène, le Cuivre, le Palladium, le Zirconium, le Rhodium, l’Iridium, le Mercure, le Platine, l’Argent, et l’Or.
Nous représentons en annexe le tableau des potentiels redox des métaux utilisés en dentisterie.
On peut considérer d’une manière générale que tout métal situé à un niveau de cette échelle sera mis en solution par un métal situé plus bas.
Par exemple, le nickel présent dans un alliage est capable de provoquer la mise en solution du fer, mais l’or sera capable de solubiliser le nickel. Le gallium est capable de solubiliser l’aluminium, le béryllium.
Cette échelle n’a rien d’absolu, car le pH et la composition chimique de la salive à certains moments de la journée peuvent fluctuer et modifier le potentiel d’électrode d’un ou de plusieurs métaux présents dans la cavité buccale. Mais ces fluctuations sont de peu d’impact sur le principe général.
Soulignons au passage le cas du Béryllium, situé tout en haut du tableau, c’est à dire passant inévitablement en solution lorsqu’il est mis en présence de tout autre métal. Combien de personnes ont encore en bouche des alliages de béryllium ? Pourtant, le pouvoir carcinogène de ce métal, même en traces n’est plus à démontrer (Encyclopédie Médico-chirurgicale Française et Merck Index).
Dans tous les processus de corrosion, des phénomènes de passivation temporaire ou de dépolarisation peuvent, soit ralentir, soit activer le passage des ions en solution.
Mais une chose est certaine, c’est que la mastication des aliments et le bruxisme érodent constamment les minces couches d’oxyde (couche de passivation) et libèrent ces substances dans le tractus digestif où l’acide chlorhydrique gastrique contribuera à la mise en solution des oxydes métalliques finement divisés. On peut considérer qu’en dépit des déclarations de certains soi-disant spécialistes, la passivation des métaux dans la cavité buccale est inexistante, vu les conditions mécaniques auxquelles les alliages sont soumis! La preuve, c’est que les alliages s’usent avec le temps! Qu’est devenu le produit de cette usure ?
L’état de surface obtenu par polissage ou par moulage n’a qu’une influence très éphémère, retardant tout au plus de quelques jours les phénomènes de corrosion. Des photos prises au microscope électronique à balayage le montrent sans équivoque possible [8]. Par contre, le polissage d’un alliage ou d’un amalgame ancien avive la superficie et réactive l’effet de pile.
Un point important doit retenir notre attention : la métallurgie classique nous apprend que les phénomènes de corrosion sont accentués par la présence d’impuretés contenues dans les métaux. Et tout métal joue pour l’ensemble de l’alliage où il est présent, le rôle d’impureté.
Un exemple douloureux pour les consommateurs est bien connu dans la sidérurgie moderne: les tôles sont fabriquées à partir de minerais de fer et de mitrailles recyclées (voitures débarrassées des éléments non métalliques, mises à la casse, compactées en ballots et enfournées telles quelles dans les haut-fourneaux. Ces ballots contiennent de l’aluminium, du zinc, du plomb, du cadmium, du chrome, du cuivre, de l’étain, etc.) et les carrosseries fabriquées à partir de ces tôles rouillent spontanément si on ne les traite pas immédiatement, à cause d’effets de micro-piles formées par les impuretés métalliques contenues dans le fer.
Une légende court parmi les dentistes, soigneusement entretenue en haut lieu : “un alliage serait un nouveau composé chimique qui n’aurait plus rien de commun avec les métaux constitutifs pris individuellement”. N’importe quel chimiste métallurgiste pourra affirmer catégoriquement et sans commettre d’erreur que dans un alliage, chaque métal conserve ses propriétés chimiques de départ, même si l’alliage a été parfaitement fondu. Aucun alliage n’est un mélange parfait ! Il existe dans tout alliage des micro-zones non homogènes où l’un des constituants forme de petits édifices cristallins de métaux purs. Chaque métal présent forme de telles micro-zones hétérogènes. Ces zones sont clairement visibles au microscope électronique à balayage. A partir de la surface, des micro-piles vont apparaître et engendrer des zones de corrosion qui vont être la source de libération d’ions métalliques. Les quantités de ces ions ne seront guère importantes, mais elles suffiront à créer des sensibilisations de type allergénique chez des sujets sensibles. (Le simple contact avec la peau ou les muqueuses, du nickel ou du cobalt, en l’absence de tout phénomène de corrosion peut engendrer un processus allergique).
Les amalgames
Les amalgames sont en quelque sorte des alliages réalisés à température ambiante. Donc, le mercure qui, à cette température est à l’état liquide, est mélangé à une poudre contenant de l’argent, du cuivre, de l’étain, du zinc et du mercure. Les particules de poudre sont des agrégats d’atomes et il va de soi que leur dispersion dans le mercure liquide laissera subsister bon nombre de ces agrégats. Il n’y aura pas de mise en solution totale des métaux dans le mercure. Examinée au microscope électronique, une coupe dans un amalgame montre des agrégats bien différenciés de l’alliage mercuriel périphérique proprement dit. Chaque grain ainsi différencié va former avec le mercure alentour, une micro-pile avec mise en solution du métal le plus électropositif, c’est à dire l’argent, le zinc, l’étain ou le cuivre. La corrosion va lentement progresser en profondeur… Si, dans la cavité buccale, on place en plus une couronne en or, une nouvelle pile va se former, mais cette fois entre le mercure et l’or et le mercure va passer en solution sous la forme d’ions Hg2+ . Des micro-excavations vont apparaître et former des canalicules qui s’étendront à la masse de l’obturation. Le phénomène de corrosion du mercure des obturations en amalgames était déjà connu des fabricants d’amalgames en Allemagne depuis les années 1960, comme cela a été formellement établi par l’Expertise de l’Institut de Toxicologie de l’Université de Kiel en 1995 [2]. Il est donc impensable que ces connaissances n’aient pas filtré dans d’autres pays européens.
De plus, une étude de l’Université de Tübingen, publiée en 1996 [9] , réalisée sur 17.000 patients a montré que les obturations en amalgame libèrent des quantités importantes de vapeurs de mercure dans la cavité buccale. Certains patients sont ainsi exposés à plus de 200 fois la norme acceptée en Allemagne pour les expositions professionnelles, en termes de dose acceptable. Les déclarations de l’Organisation Mondiale de la Santé, prétendant que l’absorption maximale de mercure pour le public en général proviendrait principalement de la consommation de poisson (et reprises en choeur par les responsables de Santé Publique) sont tout simplement ridiculisées. Il serait peut-être bon de se poser maintenant la question de savoir si les experts de l’O.M.S. ont bien pour objectif la protection de la santé. De toute manière, si telle est bien la position de ces experts, on peut s’interroger sur les motifs d’un tel manque de rigueur de la part de personnalités qui devraient être au dessus de tout soupçon.
Nous pouvons dire d’une manière générale que certains responsables de Santé Publique font preuve de grande légèreté. Ceci apparaît dans le Rapport d’Expertise de l’Université de Kiel (sans compter les pressions exercées par l’administration allemande pour étouffer l’affaire).
Le mercure contenu dans un flacon en polyéthylène souple et incassable (pour éviter de répandre le métal volatil à température ambiante), porteur d’une étiquette mettant en garde contre tout danger de manipulation devient inoffensif dans une obturation dentaire ! Le miracle s’accomplit … dans le cabinet du dentiste. Le paradoxe devient d’autant plus évident que les rejets de déchets de fraisages d’amalgames dans les cabinets dentaires posent des problèmes pour l’environnement.
Alors, les autorités se contorsionnent en essayant de prouver qu’un amalgame non gamma-2 ne libère pas de mercure, que le mercure y serait totalement fixé dans un nouveau composé chimique parfaitement stable. L’Institut de Toxicologie de Kiel [2] montre qu’en Allemagne, depuis plus de 20 ans des chercheurs universitaires ont prouvé que tous les amalgames dentaires libèrent des vapeurs de mercure et même dans certains cas de fines gouttelettes de mercure en surface. Les résultats de ces recherches ont été passées sous silence au niveau des praticiens de l’art dentaire ! Pour quelle raison ? La Science n’a-t’elle pas la même signification quand elle implique de grands lobbies industriels ?
Certains tentent également de nous montrer que l’intoxication mercurielle suite à la présence d’amalgames n’existe pas puisque les doses de mercure trouvées dans le sang et dans l’urine sont pratiquement les mêmes pour tous les individus, même pour ceux qui ne sont pas porteurs d’obturations en amalgames.(Ceci à l’exception des personnes exposées journellement dans un cadre professionnel). Ils perdent évidemment de vue que le sang et l’urine ne sont que des sites de passage pour le mercure, soit sous forme vapeur, soit sous forme de sels ou sous forme de méthyl-mercure. On apercevra une importante augmentation du mercure sanguin et urinaire le lendemain de la dépose d’un amalgame sans précautions, par exemple [9]
Rappelons qu’en toxicologie, il existe des organes-cibles et qu’une intoxication métallique va parfois consister en une lente accumulation progressive de traces du métal au niveau de ces organes. Il a fallu des années (et combien de morts par cancer) pour se rendre compte que le DDT se stocke préférentiellement dans les tissus adipeux et conjonctifs. La toxicologie du mercure nous indique que les organes-cibles du mercure sont le cerveau, les reins et le foie [10].
Certains chercheurs ont-ils pris l’habitude de chercher sous une lampe d’éclairage public la clé qu’ils ont perdue à 50 mètres de là dans une zone obscure ?
Les études allemandes de Tübingen [9] et de Kiel [2] montrent surtout que parmi la population, un grand nombre de personnes souffrent de troubles de santé liés aux obturations en amalgame. Parfois ces troubles sont graves, parfois ils se résument à un mal-être qui n’incite pas à consulter de médecin. Mais faut-il encore le répéter, ces patients souffrant de maux de tête, de névralgies, de vertiges, d’insomnies, de tremblements consomment constamment des médicaments (qui vont ajouter un nouvel effet iatrogène) et coûtent à la collectivité par diminution de productivité.
Qui entretient le flou en tentant de nous présenter des données fausses sous des aspects de vérités indiscutables ? Les problèmes historiques du sang contaminé, de l’amiante, de l’encéphalite bovine spongiforme auraient pourtant dû faire réfléchir les experts qui conseillent les politiques, à moins que les décideurs ne soient plus les politiques!
Tout ceci nous montre que la santé des citoyens n’a souvent de poids que dans les discours politiques de campagnes électorales mais qu’en réalité elle cède souvent le pas à d’énormes intérêts financiers dissimulés sous le masque de l’intérêt collectif.
Quelles solutions proposer ?
Les alliages métalliques dentaires et les amalgames posent un certain nombre de problèmes.
1.Selon nous, il est grand temps de trouver une solution de remplacement aux amalgames. Il serait vraiment paradoxal qu’à une époque où l’on dirige des fusées destinées à l’étude du sol de la lune, de Jupiter et de mars, on ne puisse trouver un matériau pouvant se substituer à l’amalgame.
2.Quant aux autres métaux, un certain nombre de données doivent être prises en considération.
Le béryllium est sans doute l’un des métaux les plus toxiques et son potentiel redox nous indique qu’il est le plus sensible aux effets d’électro-galvanisme (passage en solution). Il est d’autant plus dangereux que sa densité est faible (1,84), donc un faible pourcentage en poids de béryllium ne reflète pas la surface de corrosion qu’il présente dans un alliage (beaucoup plus élevée que sa proportion pondérale).
.Selon nous il devrait être totalement exclu de l’art dentaire et les alliages qui en contiennent devraient être immédiatement éliminés de la bouche des patients.
3. La sensibilité d’un patient à un alliage ou à un amalgame n’est pas une question de statistiques : elle est individuelle !
Avant de poser un alliage, trois opérations devront être réalisées avec l’appareil MORA afin de déterminer d’une part la tolérance du patient vis-à-vis de l’alliage et d’autre part les compatibilités électrochimiques des métaux entre eux, dans la cavité buccale.
A. LA TOXICITE On mesure les points Foie 1 et Rein 1 en maintenant l’émetteur du combiné émetteur-récepteur sur les échantillons d’alliages proposés, l’un à la suite de l’autre (le récepteur est raccordé à la douille T sous le module de mesure).
Si l’un des alliages est toxique pour le patient, le point Fo1 ou le point Re1 va accuser une valeur nettement supérieure à 50 ou une valeur en chute (danger de processus dégénératif).
Si l’alliage est compatible, le point Fo1 et le point Re1 resteront à 50.
B. LE POUVOIR ALLERGENIQUE
Mesurer sur le point Allergie 1, en maintenant l’émetteur du combiné émetteur-récepteur sur les échantillons : si un des alliages est allergénique pour le patient concerné, la mesure accusera une valeur supérieure à 50. Pour qu’un alliage puisse être considéré comme inerte, le point All.1 doit se maintenir à 50 lorsque l’alliage est sous l’émetteur TSE.
C.VERIFIER LA COMPATIBILITE ELECTROCHIMIQUE DES ALLIAGES choisis avec les alliages et amalgames déjà présents dans la bouche du patient. Ceci se réalise en plaçant l’échantillon de l’alliage dans la bouche du patient, en priant celui-ci de l’imprégner de salive. Au moyen des électrodes dentaires, en plaçant le commutateur de l’appareil MORA sur la position ZU, on mesure successivement la différence de potentiel entre l’échantillon et chaque pièce métallique. La valeur mesurée ne doit pas dépasser 50 mV.
Ces précautions évitent bien des déboires futurs, en permettant de choisir les métaux les mieux adaptés au patient concerné.
4. Lorsqu’un alliage, un amalgame ou une prothèse sont soupçonnés d’être la cause d’une réaction ou d’une perturbation énergétique d’origine électrogalvanique chez un patient, l’appareil MORA va nous permettre de choisir en connaissance de cause l’attitude à adopter.
En général, c’est d’un “blocage énergétique” général qu’il s’agit et le patient revient régulièrement à la consultation avec les mêmes point d’électroacupuncture perturbés.
Nous ne donnerons pas ici les détails des manipulations à effectuer, mais nous indiquerons simplement que nous prenons sur l’obturation ou sur la pièce métallique via une électrode dentaire une information électromagnétique supposée perturbatrice que nous fournissons à l’appareil MORA.
Celui-ci, grâce à son système d’opposition de phase, délivre à la sortie des oscillations “inversées”.
Si ces oscillations inversées (et amplifiées) corrigent les points “chroniquement perturbés”, c’est que l’obturation ou l’alliage est en cause.
Nous remplaçons à l’entrée de l’appareil MORA, l’électrode dentaire par le récepteur du combiné émetteur-récepteur TSE, et nous posons l’émetteur sur des échantillons des métaux habituellement utilisés en dentisterie.
Si un groupe de métaux situés sous l’émetteur corrige les points perturbés de la même façon que l’amalgame ou la pièce métallique, c’est que nous avons identité de signaux électromagnétiques à l’entrée de l’appareil MORA, donc identité de causes.
Grâce à une glissière écran que nous intercalons entre le capteur de l’émetteur et les échantillons de métaux, nous aurons tôt fait d’identifier avec précision le métal (ou les métaux) responsable(s).
Lorsqu’on détecte plusieurs métaux responsables, il est bon d’agir progressivement dans le démontage des travaux.
Le fait de déposer un seul alliage peut changer totalement la configuration électrogalvanique de la bouche. La proximité des alliages et leur éloignement peut changer complètement l’aspect du problème.
De plus, le seul fait d’enlever un alliage ne résoudra pas d’emblée le problème d’intoxication chronique, ou d’allergie. Il faudra provoquer chez le patient, l’élimination de la “mémoire cellulaire” de cet alliage.
Pour cela, nous aurons à nouveau recours au traitement MORA, mais sur l’ensemble du patient, en mettant à profit le filtre à résonance moléculaire.
Parfois, des dilutions homéopathiques en 200 K accompagnées d’un drainage hépato-rénal auront un effet bénéfique. Mais, certains laboratoires refusent de fournir les métaux dans cette dilution qui nous paraît irremplaçable dans ce domaine. La dynamisation 9 CH n’a pas du tout le même potentiel d’action, l’expérience de plus de 20 ans le prouve.
Références bibliographiques
[1] Soremark R. Et al., “Influence of some dental restorations on the concentrations of inorganic constituents of the teeth”,Dep. Prosth. and Clinical Lab. of Royal Sch. Dent., 1962.
[2] Wassermann et al. “Kieler Amalgam-Gutach” (Expertise réalisée par l’Institut de Toxicologie de l’Université de Kiel, sur requète du parquet de Francfort), 1997.(bientôt disponible en langue française)
[3] Harmond M.F. (INSERM S.C. 31) et al. “Odontologie, Stomatologie, expérimentation in vitro de la bicompatibilité et du comportement des métaux”, Enjeux, n?74, nov. 1986.
[4] Sigot-Luizard M.F. (CNRS) “Evaluation “in vitro” de la cytotoxicité et de la cytocompatibilité d’alliages dentaires précieux et non précieux sur culture organotypique de gencive humaine” à paraître.
[5] Wataha J.C., Malcolm C.T., Hanks C.T. “Correlation between cytotoxycity and the elements released by dental casting alloys”, Int. J. Prosthodont 8: 9-14 (1995).
[6]Philibert P.,”Protection contre la corrosion” p.12-15, Ed. Presses Universit. De France, 1973
[7] Danze J.M. “Le système Mora ou le Rationnel en Médecine Energétique” Ed. Encre, Paris, 1992.
[8] Hildebrand H.F. and Champy F., “Biocompatibility of Co-Cr-Ni Alloys”, Ed. Plenum Press, New York, 1988.
[9] Roller E., Weiss H.D., Maier K.H. “Etude de l’Université de Tübingen concernant les Amalgames dentaires” (2 parties),Institut d’Analyse de l’Environnement et Institut de Gynécologie, Univ. Tübingen 1996 (traduction en langue française disponible)
[10] Testud F. “Pathologie toxique en milieu de travail”, Ed. Lacassagne Lyon, 1993, pp.142-146.
[11] Hartwig A., Mullenders L.H.F., Schlepegrell R., Krueger I, Beyersmann D. “Interaction of nickel (II) with D.N.A. repair processes : inhibition of the incision step in nucleotide excision repair”, Metal Ions in Biology and Medicine, Paris (1994) pp.235-240.
[12] Rodilla V., Miles A.T., Hawksworth G.M., “Metal toxicity and induction of metallothionein in cultured human proximal tubular cells” , Metal ions in Biology and Medicine, Vol.4, Paris (1996) pp. 88-90.
[13] Littlefield N.A., Hass B.S., “Effect of magnesium on DNA damage from cadmium, nickel, mercury and lead”, Metal ions in Biology and Medicine, (1994) Paris, pp. 507-512.